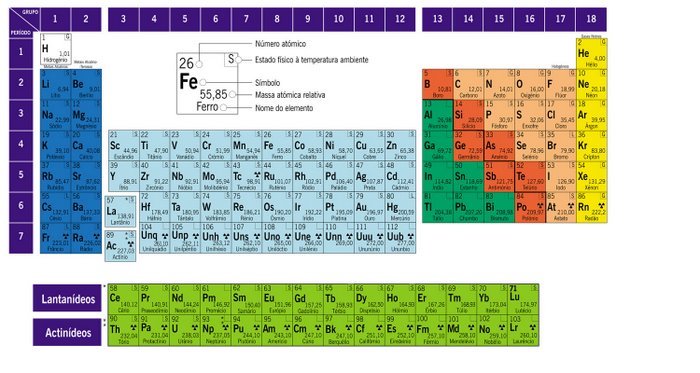
quarta-feira, 26 de setembro de 2007
Ligações Covalentes Dativa ou Coordenada
Este tipo de ligação ocorre quando os átomos envolvidos já atingiram a estabilidade com os oito ou dois elétrons na camada de valência. Sendo assim eles compartilham seus elétrons disponíveis, como se fosse um empréstimo para satisfazer a necessidade de oito elétrons do elemento ao qual está se ligando.
Ligações Covalentes ou Molecular
Ligação covalente ou molecular é aquela onde os átomos possuem a tendência de compartilhar os elétrons de sua camada de valência, ou seja, de sua camada mais instável. Neste tipo de ligação não há a formação de íons, pois as estruturas formadas são eletronicamente neutras.
Como o exemplo abaixo do oxigênio. Ele necessita de dois elétrons para ficar estável e o H irá compartilhar seu elétron com o O. Sendo assim o O ainda necessita de um elétron para se estabilizar, então é preciso de mais um H e esse H compartilha seu elétron com o O, estabilizando-o. Sendo assim é formado uma molécula o H2O.
Como o exemplo abaixo do oxigênio. Ele necessita de dois elétrons para ficar estável e o H irá compartilhar seu elétron com o O. Sendo assim o O ainda necessita de um elétron para se estabilizar, então é preciso de mais um H e esse H compartilha seu elétron com o O, estabilizando-o. Sendo assim é formado uma molécula o H2O.
Ligações Iônicas ou Eletrovalentes
Na ligação iônica há a formação de íons devido a transferência de elétrons de um átomo para o outro. Normalmente, nesta ligação, existe um elemento que tende a ceder elétrons (metal - cátion), e outro que tende a receber elétrons (não metal - ânion).
Obs: A ligação iônica é a única em que ocorre a transferência de elétrons.
Exemplo: As camadas eletrônicas do Sódio e do Cloro ficam do seguinte modo:
Na11 - K² L8 M1
Cl17 - K² L8 M7
O sódio possui 1 elétron na última camada. Basta perder este elétron para que ele fique estável com 8 elétrons na 2ª camadaL.
O cloro possui 7 elétrons na sua última camadaM. É bem mais fácil ele receber 1 elétron e ficar estável do que perder 7 elétrons para ficar estável, sendo isto o que acontece.
Agora tudo está perfeito. O sódio quer doar 1 elétron e o cloro quer receber 1 elétron. Eles se aproximam e o sódio doa seu elétron que está em excesso e o cloro o recebe.
Podemos perceber, então, o seguinte: átomos (metais) que possuem 1, 2 ou 3 elétrons em sua camada de valência tendem a perderem estes eletrons para os átomos (não-metais)que possuem 5, 6 ou 7 elétrons em sua camada de valência.
Obs: A ligação iônica é a única em que ocorre a transferência de elétrons.
Exemplo: As camadas eletrônicas do Sódio e do Cloro ficam do seguinte modo:
Na11 - K² L8 M1
Cl17 - K² L8 M7
O sódio possui 1 elétron na última camada. Basta perder este elétron para que ele fique estável com 8 elétrons na 2ª camadaL.
O cloro possui 7 elétrons na sua última camadaM. É bem mais fácil ele receber 1 elétron e ficar estável do que perder 7 elétrons para ficar estável, sendo isto o que acontece.
Agora tudo está perfeito. O sódio quer doar 1 elétron e o cloro quer receber 1 elétron. Eles se aproximam e o sódio doa seu elétron que está em excesso e o cloro o recebe.
Podemos perceber, então, o seguinte: átomos (metais) que possuem 1, 2 ou 3 elétrons em sua camada de valência tendem a perderem estes eletrons para os átomos (não-metais)que possuem 5, 6 ou 7 elétrons em sua camada de valência.
Ligaçao Quimica
As ligações químicas são uniões estabelecidas entre átomos para formarem as moléculas, que constituem a estrutura básica de uma substância ou composto. Na Natureza existem aproximadamente uma centena de elementos químicos. Os átomos destes elementos químicos ao se unirem formam a grande diversidade de substâncias químicas.
Para exemplificar podemos citar o alfabeto em que podemos juntar as letras para formar as palavras. Os átomos, comparando, seriam as letras e as moléculas seriam as palavras. Na escrita não podemos simplesmente ir juntando as letras para a formação de palavras: aasc em português não tem significado (salvo se corresponder a uma sigla); porém se organizarmos essas letras teremos casa que já tem o seu significado.
Assim como na escrita a união estabelecida entre átomos não ocorre de qualquer forma, deve haver condições apropriadas para que a ligação entre os átomos ocorra, tais como: afinidade, contato, energia etc.
As ligações químicas podem ocorrer através da doação e recepção de elétrons entre os átomos (ligação iônica). Como exemplo NaCl (cloreto de sódio). Compostos iônicos conduzem electricidade no estado derretido ou dissolvido. Eles normalmente têm um alto ponto de fusão e alto ponto de ebulição.
Outro tipo de ligações químicas ocorre através do compartilhamento de elétrons: a ligação covalente. Como exemplo H2O (água).
Existe também a ligação metálica onde os elétrons das últimas camadas dos átomos do metal saltam e passam a se movimentar livremente entre os átomos criando uma força de atração entre os átomos do metal, neste caso, não há perda de elétrons.
Para exemplificar podemos citar o alfabeto em que podemos juntar as letras para formar as palavras. Os átomos, comparando, seriam as letras e as moléculas seriam as palavras. Na escrita não podemos simplesmente ir juntando as letras para a formação de palavras: aasc em português não tem significado (salvo se corresponder a uma sigla); porém se organizarmos essas letras teremos casa que já tem o seu significado.
Assim como na escrita a união estabelecida entre átomos não ocorre de qualquer forma, deve haver condições apropriadas para que a ligação entre os átomos ocorra, tais como: afinidade, contato, energia etc.
As ligações químicas podem ocorrer através da doação e recepção de elétrons entre os átomos (ligação iônica). Como exemplo NaCl (cloreto de sódio). Compostos iônicos conduzem electricidade no estado derretido ou dissolvido. Eles normalmente têm um alto ponto de fusão e alto ponto de ebulição.
Outro tipo de ligações químicas ocorre através do compartilhamento de elétrons: a ligação covalente. Como exemplo H2O (água).
Existe também a ligação metálica onde os elétrons das últimas camadas dos átomos do metal saltam e passam a se movimentar livremente entre os átomos criando uma força de atração entre os átomos do metal, neste caso, não há perda de elétrons.
quinta-feira, 6 de setembro de 2007
Óxidos de Cálcio
O Óxido de Cálcio (conhecido como "cal") é uma das substâncias mais importantes para a indústria, sendo obtida por decomposição térmica de calcário (900°C). Também chamado de cal viva ou virgem, é um composto sólido branco.
Normalmente utilizada na indústria da construção civil para elaboração das argamassas com que se erguem as paredes e muros e também na pintura, a cal também tem emprego na indústria cerâmica, siderúrgicas (obtenção do ferro) e farmacêutica como agente branqueador ou desodorizador. O óxido de cálcio é usado para produzir hidróxido de cálcio, na agricultura para o controle de acidez dos solos, e na metalurgia extrativa para produzir escória contendo as impurezas (especialmente areia) presentes nos minérios de metais.
Obtenção
O calcário, depois de extraído, selecionado e moído, é submetido a elevadas temperaturas em fornos industriais num processo conhecido como calcinação, que dá origem ao CaO (óxido de cálcio: cal) e CO2 (gás carbônico), a equação química dessa calcinação fica assim:
CaCO3 + Calor ->> CaO + CO2
Para essa reação ocorrer à temperatura do forno da caieira (indústria produtora de cal) deve ser de, no mínimo, 850ºC, mas a eficiência total da calcinação se dá à temperatura de 900º a 1000ºC. Essa temperatura é garantida pela queima de um combustível, que pode ser: lenha (gasogênio), óleo combustível, gás natural, gás de coqueira, carvão e material reciclado.
Para a obtenção da cal hidratada é necessário promover a reação da cal virgem com água.
CaO(cal virgem)+ H2O(água)->> Ca(OH)2 (cal hidratada)
Tipos e usos da cal
A maioria da cal produzida no Brasil resulta da calcinação de calcários/dolomitos metamórficos de idades geológicas diferentes; geralmente muito antiga (pré-cambriana) e possie pureza variável. As cales provenientes de calcários sedimentares e de concheiros naturais recentes participam de maneira subordinada na produção. Em geral, na região sul-sudeste predominam as cales provenientes de dolomitos e calcários magnesianos, e na região nordeste-norte-centro, as resultantes de calcários calcíticos. O principal produto da calcinação das rochas carbonatadas cálcicas e cálcio-magnesianas é a cal virgem, também denominada cal viva ou cal ordinária. O termo cal virgem é o consagrado na literatura brasileira e nas normas da Associação Brasileira de Normas Técnicas, para designar o produto composto predominantemente por óxido de cálcio e óxido de magnésio, resultantes da calcinação, à temperatura de 900 a 1200ºC, de calcários, calcários magnesianos e dolomitos. A cal virgem é classificada conforme o óxido predominante conforme a seguir:
Cal virgem cálcica: óxido de cálcio entre 100% e 90% dos óxidos totais presentes;
Cal virgem magnesiana: Teores intermediários de óxido de cálcio, entre 90% e 65% dos óxidos totais presentes;
Cal virgem dolomítica: teores de cálcio entre 65% e 58% dos óxidos totais presentes.
No mercado global da cal, a cal virgem cálcica predomina, particularmente, pela sua aplicação nas áreas das indústrias siderúrgicas, de açúcar e de celulose. Todas elas são comercializadas em recipientes (plásticos, metálicos e outros) ou a granel, na forma de blocos (tal como sai do forno), britada (partículas de diâmetro 1 a 6 cm) ou moída e pulverizada (85% a 95% passando na peneira 0,150 mm). Outro tipo de cal muito comum no mercado é a cal hidratada. Ela é composta por um pó de cor branca resultante da combinação química dos óxidos anidros da cal virgem com a água. É classificada conforme o hidróxido predominante presente ou, melhor, de acordo com a cal virgem que lhe dá origem:
cal hidratada cálcica
cal hidratada magnesiana
cal hidratada dolomítica
A cal hidratada, geralmente, é embalada em recipientes plásticos ou em sacos de papel Kraft (com 8,20 kg e 40 kg do produto), possuindo granulometria de 85% abaixo de 0.075 mm. No Brasil, as diversificadas áreas de consumo de cal são supridas por mais de 200 produtores distribuídos pelo País. A capacidade de produção de suas instalações varia de 1 a 1000 toneladas de cal virgem por dia.
A utilização da cal hidratada é muita difundida, principalmente em argamassas para assentamento de tijolos e revestimento de paredes, devido a algumas características da cal, como as relativas a trabalhabilidade e durabilidade das argamassas.
A cal hidratada tem características aglomerantes como o cimento, sendo que, enquanto o cimento reage com água (reação de hidratação do cimento), o endurecimento da cal aérea ocorre pelo contato com o ar. Essa reação transforma a cal hidratada num carbonato tão sólido quanto o calcário que a originou.
O uso da cal como aglomerante, no Brasil, deve-se: à dispersão geográfica das suas usinas de fabricação – face às ocorrências de calcários e dolomitos por quase todo o território nacional, à facilidade e abundância da sua oferta – ainda que para cales especiais, o suprimento às vezes implique transporte mais longo e ao seu baixo custo – o menor entre os reagentes químicos alcalinos e os aglomerantes cimentantes.
Normalmente utilizada na indústria da construção civil para elaboração das argamassas com que se erguem as paredes e muros e também na pintura, a cal também tem emprego na indústria cerâmica, siderúrgicas (obtenção do ferro) e farmacêutica como agente branqueador ou desodorizador. O óxido de cálcio é usado para produzir hidróxido de cálcio, na agricultura para o controle de acidez dos solos, e na metalurgia extrativa para produzir escória contendo as impurezas (especialmente areia) presentes nos minérios de metais.
Obtenção
O calcário, depois de extraído, selecionado e moído, é submetido a elevadas temperaturas em fornos industriais num processo conhecido como calcinação, que dá origem ao CaO (óxido de cálcio: cal) e CO2 (gás carbônico), a equação química dessa calcinação fica assim:
CaCO3 + Calor ->> CaO + CO2
Para essa reação ocorrer à temperatura do forno da caieira (indústria produtora de cal) deve ser de, no mínimo, 850ºC, mas a eficiência total da calcinação se dá à temperatura de 900º a 1000ºC. Essa temperatura é garantida pela queima de um combustível, que pode ser: lenha (gasogênio), óleo combustível, gás natural, gás de coqueira, carvão e material reciclado.
Para a obtenção da cal hidratada é necessário promover a reação da cal virgem com água.
CaO(cal virgem)+ H2O(água)->> Ca(OH)2 (cal hidratada)
Tipos e usos da cal
A maioria da cal produzida no Brasil resulta da calcinação de calcários/dolomitos metamórficos de idades geológicas diferentes; geralmente muito antiga (pré-cambriana) e possie pureza variável. As cales provenientes de calcários sedimentares e de concheiros naturais recentes participam de maneira subordinada na produção. Em geral, na região sul-sudeste predominam as cales provenientes de dolomitos e calcários magnesianos, e na região nordeste-norte-centro, as resultantes de calcários calcíticos. O principal produto da calcinação das rochas carbonatadas cálcicas e cálcio-magnesianas é a cal virgem, também denominada cal viva ou cal ordinária. O termo cal virgem é o consagrado na literatura brasileira e nas normas da Associação Brasileira de Normas Técnicas, para designar o produto composto predominantemente por óxido de cálcio e óxido de magnésio, resultantes da calcinação, à temperatura de 900 a 1200ºC, de calcários, calcários magnesianos e dolomitos. A cal virgem é classificada conforme o óxido predominante conforme a seguir:
Cal virgem cálcica: óxido de cálcio entre 100% e 90% dos óxidos totais presentes;
Cal virgem magnesiana: Teores intermediários de óxido de cálcio, entre 90% e 65% dos óxidos totais presentes;
Cal virgem dolomítica: teores de cálcio entre 65% e 58% dos óxidos totais presentes.
No mercado global da cal, a cal virgem cálcica predomina, particularmente, pela sua aplicação nas áreas das indústrias siderúrgicas, de açúcar e de celulose. Todas elas são comercializadas em recipientes (plásticos, metálicos e outros) ou a granel, na forma de blocos (tal como sai do forno), britada (partículas de diâmetro 1 a 6 cm) ou moída e pulverizada (85% a 95% passando na peneira 0,150 mm). Outro tipo de cal muito comum no mercado é a cal hidratada. Ela é composta por um pó de cor branca resultante da combinação química dos óxidos anidros da cal virgem com a água. É classificada conforme o hidróxido predominante presente ou, melhor, de acordo com a cal virgem que lhe dá origem:
cal hidratada cálcica
cal hidratada magnesiana
cal hidratada dolomítica
A cal hidratada, geralmente, é embalada em recipientes plásticos ou em sacos de papel Kraft (com 8,20 kg e 40 kg do produto), possuindo granulometria de 85% abaixo de 0.075 mm. No Brasil, as diversificadas áreas de consumo de cal são supridas por mais de 200 produtores distribuídos pelo País. A capacidade de produção de suas instalações varia de 1 a 1000 toneladas de cal virgem por dia.
A utilização da cal hidratada é muita difundida, principalmente em argamassas para assentamento de tijolos e revestimento de paredes, devido a algumas características da cal, como as relativas a trabalhabilidade e durabilidade das argamassas.
A cal hidratada tem características aglomerantes como o cimento, sendo que, enquanto o cimento reage com água (reação de hidratação do cimento), o endurecimento da cal aérea ocorre pelo contato com o ar. Essa reação transforma a cal hidratada num carbonato tão sólido quanto o calcário que a originou.
O uso da cal como aglomerante, no Brasil, deve-se: à dispersão geográfica das suas usinas de fabricação – face às ocorrências de calcários e dolomitos por quase todo o território nacional, à facilidade e abundância da sua oferta – ainda que para cales especiais, o suprimento às vezes implique transporte mais longo e ao seu baixo custo – o menor entre os reagentes químicos alcalinos e os aglomerantes cimentantes.
Nomenclatura dos Óxidos
ÓXIDOS METAIS
Óxido de [Nome do Metal], caso o cátion apresente somente uma carga
Na2O Óxido de Sódio
ZnO Óxido de Zinco
Al2O3 Óxido de Alumíno
Caso o elemento apresente mais de uma carga, poderemos utilizar Óxido de [nome do elemento] + carga do elemento.
Fe2O3 Óxido de Ferro III
SnO2 Óxido de estanho IV
Pode-se também fazer uso dos sufixos ico (maior Nox) e oso (menor Nox), para o caso do elemento apresentar duas cargas.
Fe2O3 Óxido férrico
FeO Óxido ferroso
Cu2O Óxido cuproso
CuO Óxido cúprico
SnO Óxido estanoso
SnO2 Óxido estânico
ÓXIDOS AMETAIS
[Mono, Di, Tri...] + Óxido de [(Mono), Di, Tri] + [Nome do Ametal]
SO3 Trióxido de (Mono)Enxofre
N2O5 Pentóxido de Dinitrogênio
ÓXIDOS ÁCIDOS
[Nome do Ametal]+[oso (nox +3 ou +4) e ico (nox +5 ou +6)]
SO3 Óxido Sulfúrico
SO2 Óxido Sulfuroso
Exceção:
CO2 Óxido Carbônico
Obtido em "http://pt.wikipedia.org/wiki/%C3%93xido"
Óxido de [Nome do Metal], caso o cátion apresente somente uma carga
Na2O Óxido de Sódio
ZnO Óxido de Zinco
Al2O3 Óxido de Alumíno
Caso o elemento apresente mais de uma carga, poderemos utilizar Óxido de [nome do elemento] + carga do elemento.
Fe2O3 Óxido de Ferro III
SnO2 Óxido de estanho IV
Pode-se também fazer uso dos sufixos ico (maior Nox) e oso (menor Nox), para o caso do elemento apresentar duas cargas.
Fe2O3 Óxido férrico
FeO Óxido ferroso
Cu2O Óxido cuproso
CuO Óxido cúprico
SnO Óxido estanoso
SnO2 Óxido estânico
ÓXIDOS AMETAIS
[Mono, Di, Tri...] + Óxido de [(Mono), Di, Tri] + [Nome do Ametal]
SO3 Trióxido de (Mono)Enxofre
N2O5 Pentóxido de Dinitrogênio
ÓXIDOS ÁCIDOS
[Nome do Ametal]+[oso (nox +3 ou +4) e ico (nox +5 ou +6)]
SO3 Óxido Sulfúrico
SO2 Óxido Sulfuroso
Exceção:
CO2 Óxido Carbônico
Obtido em "http://pt.wikipedia.org/wiki/%C3%93xido"
Assinar:
Postagens (Atom)